Los tumores son sensibles a los aumentos de temperatura, pudiendo dichos incrementos (denominados hipertermia) conducir a una reducción en el tamaño del tumor, a muerte celular, y a la activación del sistema inmune.1–4 La hipertermia puede ser generada mediante el uso de nanopartículas magnéticas (SPIONs = superparamagnetic iron oxide nanoparticles), mediante luz, o por otros medios.5–7 Cuando estas nanopartículas magnéticas son expuestas a campos magnéticos alternos, absorben energía del campo y luego la liberan, generando de este modo calor. Al aumentar la temperatura del tumor por encima de los valores fisiológicos, en el rango entre 42°C y 45°C, se inducen fenómenos deletéreos a nivel celular (ej. denaturación de proteínas) y de los tejidos, que pueden afectar al tumor, a su sobrevida y potencial metástasis.
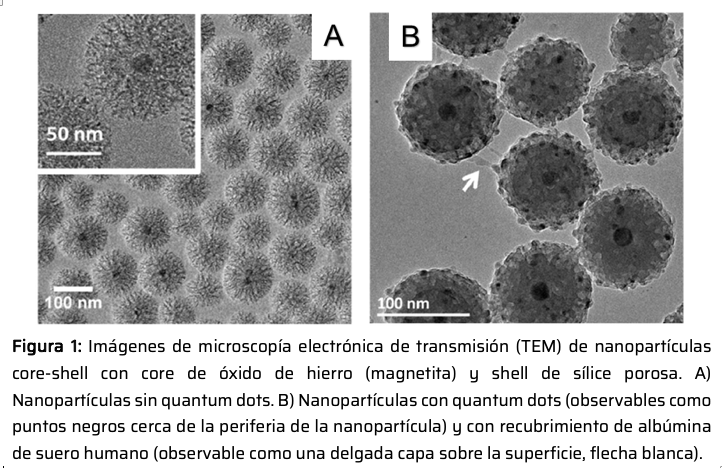
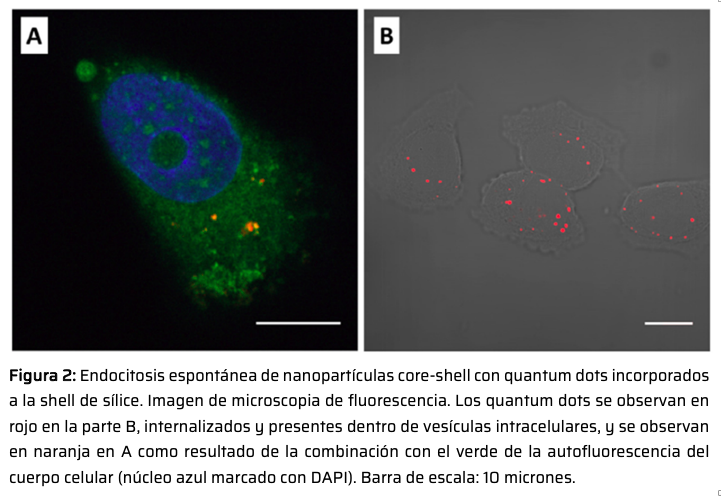
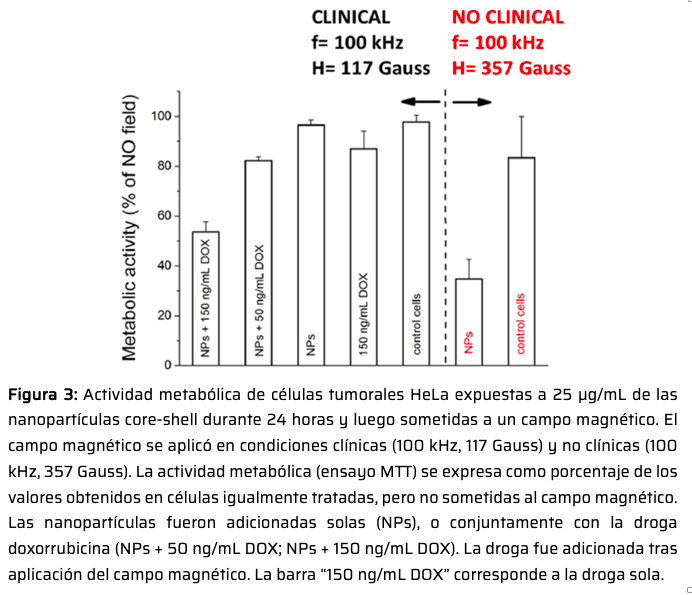
En este proyecto, se analiza la capacidad de nanopartículas formadas por un centro (core) magnético rodeado de una capa (shell) porosa de sílice de afectar el crecimiento tumoral. La capa porosa de sílice presenta un tamaño de poro aproximado de 10 nm. En un primer trabajo,8 las nanoestructuras core-shell fueron modificadas mediante la incorporación de quantum dots, QDs (Figura 1), lo cual permitía localizar fácilmente a las partículas intracelularmente gracias a la fluorescencia de los QDs. Finalmente, la superficie de las nanopartículas se recubrió con albúmina de suero humano (HSA) para minimizar la opsonización. Con este sistema, se observó que las nanopartículas core-shell conteniendo QDs eran endocitadas espontáneamente por células tumorales humanas (HeLa) y acumuladas en vesículas (Figura 2). Esta endocitosis espontánea posibilitó la evaluación del efecto del campo magnético sobre la viabilidad celular, tanto bajo condiciones clínicas (100 kHz, 117 Gauss) de campo magnético como bajo condiciones más extremas (100 kHz, 357 Gauss) (Figura 3). En condiciones clínicas, sólo la presencia en solución de la droga quimioterapéutica doxorrubicina (DOX) en conjunto con las nanopartículas magnéticas arrojó una reducción en la viabilidad celular, siendo este efecto mayor a mayores concentraciones de la droga.
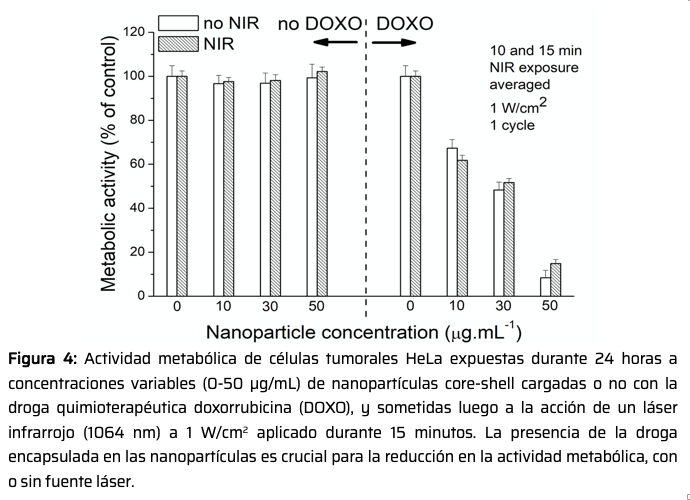
En la siguiente etapa, se procuró cargar las nanopartículas (sin quantum dots) con la droga doxorrubicina y determinar la capacidad de estos nanosistemas para liberar de un modo controlado a la droga encapsulada9 y para, así mismo, producir muerte celular (Figura 4). Aquí, la hipertermia fue inducida mediante aplicación de un láser infrarrojo (1064 nm) a 1 W/cm2, aplicado durante 15 minutos. El efecto citotóxico es claro cuando las nanopartículas contienen la droga doxorrubicina encapsulada, sea en ausencia o en presencia de la fuente láser.
Colaboradores:
Prof. Sylvie-Bégin Colin, Dr. Damien Mertz. Institut de Physique et Chimie des Matériaux de Strasbourg, CNRS, Université de Strasbourg, Francia.
Prof. Florent Meyer, Lic. Christine Affolter-Zbaraszczuk. Centre de Recherche en Biomédecine de Strasbourg, UMR 1121, Université de Strasbourg, Francia.
Prof. Marcela Fernández van Raap. Instituto de Física de La Plata, CONICET, UNLP, Argentina.
Dr. Fiorela Ghilini, Lic. Micaela Vivanco. Instituto de Investigaciones Fisicoquímicas Teóricas y Aplicadas, CONICET, UNLP, Argentina.
Dr. Sébastien Harlepp. Institut de Cancérologie Strasbourg Europe, Francia.
Dr. Jacky Goetz. Centre de Recherche en Biomédecine de Strasbourg, UMR 1109, Université de Strasbourg, Francia.
Referencias:
1. Atanackovic, D., Nierhaus, A., Neumeier, M., Hossfeld, D. K. & Hegewisch-Becker, S. 41.8°C whole body hyperthermia as an adjunct to chemotherapy induces prolonged T cell activation in patients with various malignant diseases. Cancer Immunology, Immunotherapy 51, 603–613 (2002).
2. Frey, B. et al. Old and new facts about hyperthermia-induced modulations of the immune system. International Journal of Hyperthermia 28, 528–542 (2012).
3. Ito, A. et al. Complete regression of mouse mammary carcinoma with a size greater than 15 mm by frequent repeated hyperthermia using magnetite nanoparticles. J Biosci Bioeng 96, 364–369 (2003).
4. Hilger, I. In vivo applications of magnetic nanoparticle hyperthermia. International Journal of Hyperthermia 29, 828–834 (2013).
5. Nijhawan, G., Nijhawan, S. S. & Sethi, M. Hyperthermia Treatments. in Noble Metal-Metal Oxide Hybrid Nanoparticles: Fundamentals and Applications 241–263 (Elsevier, 2018). doi:10.1016/B978-0-12-814134-2.00012-7.
6. Cazares-Cortes, E. et al. Recent insights in magnetic hyperthermia: From the “hot-spot” effect for local delivery to combined magneto-photo-thermia using magneto-plasmonic hybrids. Advanced Drug Delivery Reviews vol. 138 233–246, https://doi.org/10.1016/j.addr.2018.10.016 (2019).
7. Fratila, R. M. & de la Fuente, J. M. Introduction to Hyperthermia. Nanomaterials for Magnetic and Optical Hyperthermia Applications 1–10, https://doi.org/10.1016/B978-0-12-813928-8.09997-X (2018).
8. Perton, F. et al. Fluorescent and magnetic stellate mesoporous silica for bimodal imaging and magnetic hyperthermia. Appl Mater Today 16, 301–314 (2019).
9. Adam, A. et al. Core-shell iron oxide@stellate mesoporous silica for combined near-infrared photothermia and drug delivery: Influence of pH and surface chemistry. Colloids Surf A Physicochem Eng Asp 640, 128407 (2022).